
Resumen
El siguiente reporte de caso describe la presentación del síndrome inflamatorio multisistémico asociado a la infección por el coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2 por sus siglas en inglés) en niños, que inicialmente se comparó con el síndrome mucocutáneo linfonodular, mejor conocido como enfermedad de Kawasaki clásica. Sin embargo, existen marcadas diferencias entre ambos síndromes, como se observará en el desarrollo del caso clínico, el cual cursa con un importante compromiso pulmonar, desarrollando un síndrome de distress respiratorio agudo pediátrico y posteriormente secuelas cardiovasculares que determinan el desenlace desfavorable. En este caso, la paciente desarrolló las manifestaciones de gravedad al sexto día de enfermedad y se inició cuidados intensivos oportunos con soporte aminérgico, ventilación con maniobras de protección alveolar e inicio temprano de inmunoglobulinas, lo que permitió el destete progresivo de todas las medidas instauradas. Así como se obtuvieron aciertos en el manejo intensivo, otros aspectos de la terapéutica se van dejando de lado con el mayor conocimiento de esta entidad y su reconocimiento temprano.
Palabras clave SARS-CoV2, MIS-C, Síndrome inflamatorio multisistémico, COVID-19.The clinical case report describes the presentation of multisystemic inflammatory syndrome associated with infection by severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) in children, an entity that was initially compared with lymphonodular mucocutaneous syndrome, better known as classic Kawasaki disease. However, there are marked differences between one syndrome and the other one, as will be detailed a posteriori. Presenting a significant pulmonary involvement, depeloping a pediatric acute respiratoy distress syndrome and later cardiovascular sequelae wich led to drawback outcomes. Severity was shown at sixth day and timely intensive care with aminergic support, ventilation with alveolar protection maneuvers, and early initiation of immunoglobulins were stablished, wich allowed progressive improvements. As well as successes were obtained in the intensive management, other aspects of the therapy are being put aside with the greater knowledge of this diseasse and its eartly recognition.
Keywords: Coronavirus Infections, Dental Clinic, Containment of biohazards, Decision making, Pandemic.Introducción
Introducción Las manifestaciones de la infección por SARS-Cov-2 en niños son menos frecuentes y graves respecto a los presentados en la población adulta1. Un porcentaje significativo de ellos es asintomático (hasta 15 % de los casos) lo cual ha tenido implicaciones notables en la difusión del virus en la comunidad2-5. Desde el inicio de la pandemia por COVID-19, la experiencia en China, en la primera caracterización epidemiológica de COVID-19 publicada el 17 de febrero de 2020 por los Centros de Control y Prevención de Enfermedades de China (CDC/China, por sus siglas en inglés), los casos pediátricos reportados eran del menos del 2 % y solo se documentaba una muerte en el grupo de adolescentes. A medida se desarrollaba la pandemia se observó un rápido aumento de los casos durante la primera etapa, seguida de una gradual y constante disminución. Aún así, los casos graves y críticos representaban un pequeño porcentaje del total reportado (alrededor del 6 % de los casos) 1-5.
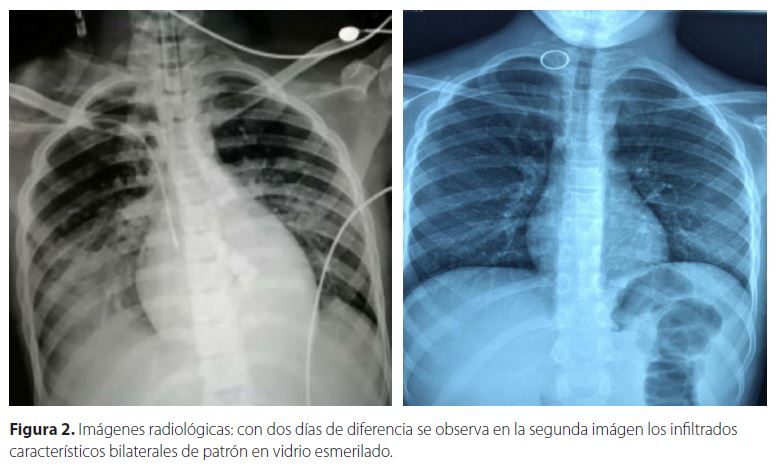
De los que requerían hospitalización la causa era dificultad respiratoria o neumonía y en los casos críticos se observó un aumento en los niveles séricos de los mediadores inespecíficos de inflamación6-7 rápida progresión a Síndrome de distress respiratorio agudo pediátrico (PARDS por sus siglas en inglés) o falla respiratoria caracterizado por un patrón radiológico de consolidaciones uni o bilaterales con apariencia en vidrio esmerilado8, pudiendo asociarse choque, encefalopatía, lesión miocárdica o insuficiencia cardíaca, coagulopatía e insuficiencia renal aguda.5-8
El síndrome inflamatorio multisistémico en niños (MIS-C) es una afección recientemente descrita publicada en la revista Lancet el 7 de mayo de 20209, donde se observó un brote sin precedentes de 8 niños evaluados a mediados de abril con esta entidad, la cual está temporalmente asociada con la exposición al coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2), con características que recuerda tanto a la enfermedad de Kawasaki como al síndrome de choque tóxico. Al 29 de marzo del 2021 los CDC reportaron en Estados Unidos un total 3185 casos que cumplen la definición de caso de MIS-C y 36 muertes8.
Entre otras características del síndrome se observaba falla ventricular izquierda, estados de choque hiper inflamatorio y necesidad de ingreso a unidades de cuidados intensivos pediátricos8-14. Se han descrito además en categorías étnicas específicas de niños, en particular niños afroamericanos, afrocaribeños y latinos12-14.
Los CDC denominan esta entidad como Síndrome inflamatorio multisistémico en niños (MIS-C por sus siglas en inglés)15-17 y se define en la guía de orientación provisional de la Academia Americana de Pediatría de la siguiente manera: • Paciente < de 21 años que presenta fiebre ( > 38.0°C durante ≥24 horas, o reporte de fiebre subjetiva que dura ≥ 24 horas). • Evidencia de laboratorio de inflamación (que incluye, pero no se limita a, uno o más de los siguientes: PCR, VES, fibrinógeno, procalcitonina, dímero-D, ferritina, deshidrogenasa láctica, interleucina 6 o neturófilos elevados; linfocitos reducidos y albúmina baja). • Evidencia de enfermedad clínicamente grave que requiere hospitalización, con compromiso multisistémico involucrando > 2 órganos (cardíaco, renal, respiratorio, hematológico, gastrointestinal, dermatológico o neurológico). • No hay diagnósticos alternativos posibles. • Resultado positivo para infección actual o reciente de SARS-CoV-2 por RT-PCR, prueba de anticuerpos o prueba de antígenos o exposición a un caso sospechoso o confirmado de COVID-19 dentro de las 4 semanas previas al inicio de los síntomas.
Algunas personas pueden cumplir criterios completos o incompletos para la enfermedad de Kawasaki. Sin embargo, en el contexto actual deben ser reportadas como MIS-C si cumplen la definición de caso. Se debe considerar la posibilidad de MIS-C en cualquier muerte pediátrica con evidencia de infección por SARS-CoV-2.
En todos los casos reportados en este período la IgG fue positiva en el 80 % mientras que IgM solo en 30 %; más del 80 % tuvo síntomas gastrointestinales y dos de ellos requirieron, incluso, laparotomía exploratoria por abdomen agudo. La mayoría de casos fue admitido en la unidad de cuidados intensivos pediátricos, requirieron fármacos inotrópicos y el estudio ecocardiográfico evidenció afección coronoraria o derrames pericárdicos en mayor proporción que las observadas en EK clásica.
Sobre los tratamientos de primera línea hasta el momento estudiados se puede citar una cohorte retrospectiva publicada el 1 de febrero de 2021 por Ouldali18-20 donde se estudian 111 casos de niños que presentaron MIS-C que cumplían definición de caso según la OMS, reportados a la agencia pública de salud de Francia, los cuales se dividieron con base en el tratamiento de primera línea utilizado en dos grupos: los que recibieron tratamiento combinado de inmunoglobulina a dosis de 2 gr/kg número de 1 dosis en asociación a metilprednisolona a dosis de 0.8 a 1 mg por kilo dosis 2 veces al día (máximo 30 mg en 12 horas) por 5 días y los que recibieron tratamiento únicamente con inmunoglobulina. El esquema combinado se asoció con un porcentaje menor de falla al tratamiento (9 %) con significancia estadística importante (valor de p = .008) en contraste con el grupo que utilizó el esquema de inmunoglobulina sola, en el cual se observó 51 % de falla al tratamiento. Sin embargo, la mejor estrategia terapéutica sigue siendo desconocida.20
Presentación del caso 4/6/20Femenina de 11 años de edad previamente sana, sin antecedentes familiares contributorios, procedente del municipio de Soyapango, departamento de San Salvador, quien consultó con historia de 4 días de inicio de fiebre intermitente, cuantificada de 38 a 40 grados centígrados, que cede momentáneamente a la administración de antipiréticos orales, aparecimiento de masa cervical izquierda, dolorosa, unilateral, incrementa progresivamente sus dimensiones, de 8 a 10 cms de diámetro y dificulta la movilidad cervical. Un día previo a la consulta presenta exantema difuso con distribución predominante en extremidades, no pruriginoso ni palpable, inyección conjuntival bilateral no purulenta, descamación de labios, queilitis angular dolorosa y eritema lingual, dolor abdominal cólico de moderada intensidad y evacuaciones diarreicas líquidas no sanguinolentas. En la Figura 1 se pueden observar algunas de las manifestaciones clínicas iniciales.

Los signos vitales al ingreso: frecuencia cardíaca 100/minuto, presión arterial 103/58 mmHg, frecuencia respiratoria 19/minuto, superficie corporal 1,68 m2, peso: 37 kg, talla: 139 cm. A las 48 horas desarrolla dificultad respiratoria y signos de choque con resistencias vasculares disminuidas (pulsos saltones, llenado capilar menor de 2 segundos, extremidades calientes).
Su evaluación secuencial de insuficiencia orgánica (SOFA, por sus siglas en inglés), se incrementó de 0 puntos al ingreso a 12 puntos en la evaluación posterior, al igual que la puntuación de riesgo de mortalidad pediátrica III (PRISM III, por sus siglas en inglés) de 0 a 16 puntos.
La radiografía de tórax mostraba nuevas radio-opacidades bilaterales con tendencia a consolidar, a predominio de base derecha, las cuales pueden apreciarse en la Figura 2 “Radiografías torácicas”. Silueta cardíaca con índice cardíaco de 0,4, índice de oxigenación de 17, relación PaO2/FiO2 de 96.
Se realizó tomografía axial computarizada (TAC) de cuello donde se observa masa de 10 x 5 cm en tejidos blandos sin infiltración a planos profundos bien localizada, no vascularizada, de una sola densidad y ecocardiografía, la cual revela: derrame pericárdico moderado, gasto cardíaco de 7.2 Lt/min, fracción de inyección del ventrículo izquierdo 57 %, fracción de acortamiento del 28 %, no dilatación de cavidades y arterias coronarias sin anormalidades (Figura 3)
 Intervención terapéutica
Intervención terapéutica
Se brinda soporte aminérgico con cronotrópicos e inotrópicos positivos (adrenalina) además de vasopresores (norepinefrina). Se asegura vía aérea como estrategia de manejo del choque y redistribución del gasto cardíaco al someter a ventilación mecánica convencional bajo sedación, analgesia y relajantes musculares. Se administraron dos dosis de inmunoglobulina a 1 gr por kilo de peso, con una semana de separación entre la primera y segunda aplicación, ivermectina 12 mg VO cada día por 3 días, antibióticoterapia inicialmente con ceftriaxona a 100 mg/kg/día y azitromicina 10 mg por Kg al día por 3 días. Posteriormente al evidenciar el deterioro clínico de la paciente y hallazgos radiológicos compatibles con neumonía se cambian antibióticos a meropenem dosis de 120 mg/kg/día dividido en 3 dosis y vancomicina a 60mg/kg/día dividido en 4 dosis), totalizando 15 días de antibióticoterapia; además, profilaxis antitrombótica con enoxaparina 40 mg subcutáneo cada día. Al inicio de ella se suspende ácido acetil salicílico con 3 días de tratamiento. Entre otras medidas de soporte se mantuvo el control de la glucemia, balance hídrico neutral o ligeramente negativo e inhibidores de secreción ácida gástrica mientras se restringía la vía enteral.
Evolución clínicaTras 7 días de ventilación convencional con estrategias de protección alveolar, se observa disminución del índice de oxigenación a 2,3 y una relación Pa02/FiO2 de 344. Se realizan pruebas para valorar extubación (NIF y P,01) evidenciando alteración central de la respiración y adecuada fuerza inspiratoria negativa. Se toma TAC cerebral que refleja colapso parcial de ventrículos laterales, disminución en la diferenciación de sustancia gris y blanca así como en la definición de circunvoluciones cerebrales, por lo que se cataloga como edema cerebral, se brinda manejo neurointensivo por 72 horas y posteriormente se da ventana neurológica, administrando además una segunda dosis de inmunoglobulina. Posterior a pruebas con CPAP y taller de NIF y P01 con resultado apto y administración de esteroides 12 horas previas, se realiza extubación electiva con éxito.
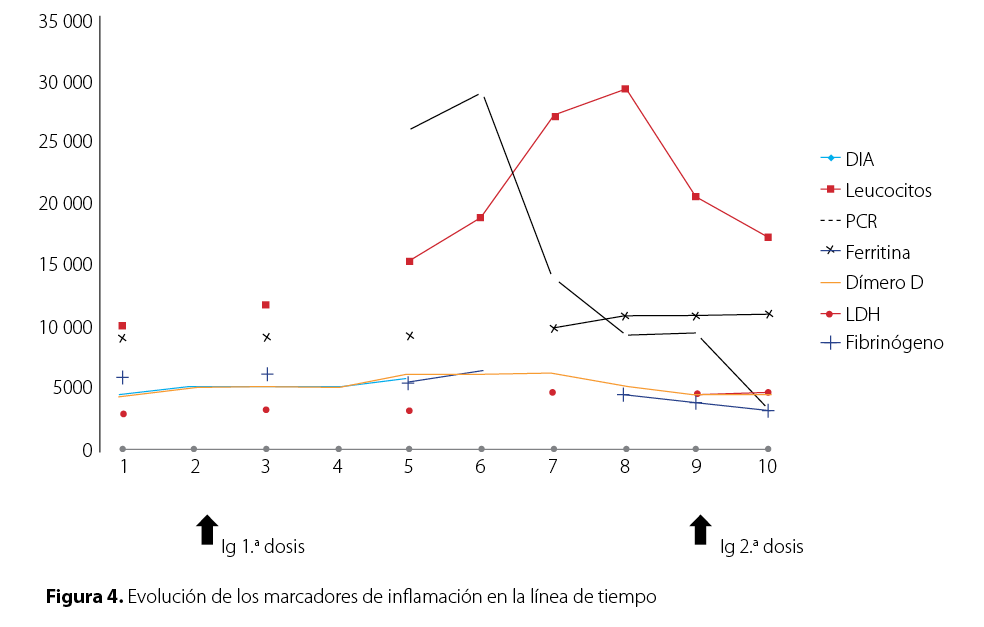
En la Figura 4 “Evolución de los marcadores de inflamación en la línea de tiempo” puede observarse la evolución en el tiempo de los marcadores de inflamación y su descenso en relación con la aplicación de inmunoglobulina, coincidentes éstas características con las manifestaciones clínicas. La paciente requirió en la fase poscrítica soporte inotrópico de mantemiento por disfunción sistólica leve, soporte nutricional, fisioterapia.
Pruebas tomadas en el día 6 de enfermedad RT-PCR para SARS-Cov-2 negativa, IgM negativa, IgG positiva.
 Discusión
Discusión
Este reporte de caso tiene las limitantes de ser un caso único y que los datos fueron recopilados de forma retrospectiva. Los manejos que se brindaron se basaron en la evidencia terapéutica sobre la enfermedad para esa fecha, los lineamientos establecidos por el Ministerio de Salud y en la capacidad resolutiva del hospital, al igual que los estudios de laboratorio y gabinete. Además, el tiempo de espera para el resultado de las pruebas para detección de SARS-CoV-2 a inicios de la pandemia en El Salvador demoraba hasta una semana. Sin embargo, a pesar de las limitantes, estos permitieron categorizar la enfermedad con base en los criterios internacionales, tomar decisiones importantes sobre el tratamiento y hacer diagnóstico diferencial con otras entidades.
La paciente se encontraba en el rango de edades que propone la definición de caso del CDC, la cual, a diferencia de la EK clásica, se observa en mayor proporción en lactantes así como el antecedentes de manifestaciones gastrointestinales observado en más del 90 % de los casos de MIS-C, la afección de mucosas, conjuntivas, adenitis cervical, que suele ser mayor de 1.5 cm más no supera los 3 cm. Sin embargo, en la paciente se observaba una notable adenitis unitlateral de 10 por 8 cm de diámetro, lo que obligó a considerar otros diagnósticos como enfermedad mieloproliferativa, absceso y la clásica enfermedad de Kawasaki. Agregado a ello, se observó afección de dos órganos, afecciones cardíacas como derrame pericárdico, disfunción miocárdica, signos y síntomas de afección pulmonar y necesidad de internamiento a UCIP; todas ellas se dieron en el contexto de una enfermedad febril que presentó exacerbación en el día 6 de enfermedad.
La procedencia de la paciente era del municipio de Soyapango, el cual durante toda la pandemia, y a la fecha, ha ocupado el segundo lugar con mayor número de casos de COVID-19 reportados, según datos del Ministerio de Salud; pertenece al departamento de San Salvador, el de mayor número de enfermos a la fecha. Sin embargo, no se documentó nexo epidemiológico de la paciente con casos confirmados o sospechosos.
Los hallazgos de laboratorio que comúnmente se observan en otros casos de MIS-C reportados estuvieron presentes en la paciente: nivel anormal de marcadores de inflamación, linfopenia, neutrofilia y trombocitopenia; pruebas para COVID tomadas en el día 4 de enfermedad RT-PCR negativa, Anticuerpos IgM negativo, IgG positivo. Esto coincide con información de los primeros casos reportados en New York, donde el 80 % presentaba IgG positivas. Así misimo, la elevación de mediadores de inflamación, entre ellos dímero-D, PCR, ferritina, presentando un acmé en la fase crítica de la enfermedad, no se midieron niveles de pro-calcitonina para contrastar su comportamiento con los niveles de PCR y ver su correlación con la clínica presentada. Tras la primera dosis de inmunoglobulina, la cual se administró a 1 gr por kilo, dosis que está por debajo de la recomendada en nuevas publicaciones. Pese a ello se observó un descenso en los marcadores de inflamación y fue necesaria una segunda dosis a los 7 días, presentando un descenso mayor y coincidencia con la mejoría clínica de la paciente. Al igual que en algunos casos reportados en la literatura mundial, se evidencia además de las manifestaciones gastrointestinales y multiinflamatorias un importante compromiso de la función respiratoria, llegando a establecerse un síndrome de distress respiratorio agudo pediátrico, lo cual complicó aún más la evolución y complejidad del caso. Sin embargo, presentó una respuesta favorable a ventilación convencional siguiendo maniobras de protección alveolar y medidas de sostén.
Debido a la inestabilidad hemodinámica de la paciente y hallazgos radiológicos de neumonía, se decidió realizar cambios respecto a la cobertura de antibióticos inicial a meropenem y vancomicina, totalizando 15 días de este último esquema. Se agregó, además, ivermectina como lo sugería el protocolo hospitalario emitido por el Ministerio de Salud el 6 de julio de 2020 para el tratamiento intrahospitalario del paciente con sospecha de COVID (previo al resutado de la prueba PCR-RT).
Como en series de casos reportados del patrón de ventilación pulmonar, el fenotipo de mejor pronóstico es el que se observaba en la paciente: adecuada complianza y valores de dímero – D ligeramente elevados, lo cual se vio reflejado en la drástica mejoría de los índices de oxigenación pulmonar.
Hemodinámicamente se observó un patrón de choque hipotenso con resistencias vasculares aumentadas que respondió de forma favorable al uso de aminas vasoactivas y agentes vasopresores.
En el ecocardiograma realizado a los 7 días de enfermedad no se observan como en otros casos reportados en la literatura mundial refringencia o dilatación de las coronarias, más sí datos compatibles con miocarditis, disfunción sistólica y mantenimiento inicial de adecuada fraccción de eyección a expensas del soporte inotrópico, además de un derrame pericárdico leve. No se especifica volumen que no requiere drenaje.
A pesar de superar el primer episodio de enfermedad, las infecciones nosocomiales y las secuelas cardiovasculares jugaron un papel importante en el pronóstico de la paciente excediendo las opciones terapéuticas disponibles en el país.
ConclusionesLa identificación y abordajes tempranos del choque, así como el inicio oportuno del soporte aminérgico, juegan un papel importante en el pronóstico del paciente.
La dificultad para sellar un diagnóstico apoyado por pruebas confirmatorias, así como la presentación atípica del caso, con compromiso multi orgánico, respresenta un reto en el manejo y elección apropiada de la terapéutica.
Es importante mantener maniobras de protección alveolar durante el manejo de niños con PARDS independientemente de su etiología.
La mejor estrategia como manejo de primera línea en el MIS-C aún es desconocida. Sin embargo, es importante considerar los resultados de la cohorte publicada en febrero de 2021 que asegura que la combinación de inmunoglobulina y metilprednisolona presentó mejor evolución del curso febril de la enfermedad y pudo asociarse a menor número de secuelas e internamientos en la unidad de cuidados intensivos, en contraste con el esquema aislado de inmunoglobulina. Son necesarios otros estudios en esta entidad para considerar el uso de antiagregantes plaquetarios dosificados según la fase de la enfermedad con el fin de prevenir eventos isquémicos a posteriori.
En el abordaje infectológico, a pesar de que no se ha esclarecido a la fecha el mejor tratamiento, se han descartado opciones sugeridas al inicio de la pandemia, tal es el caso de ivermectina. A medida se tiene mayor conocimiento y experiencia de la enfermedad se hace un abordaje diagnóstico y terapéutico más racional, así como una mejor elección de la antibióticoterapia disponible.
En el paciente que ha requerido ventilación. Antes de realizar la extubación electiva se necesita apoyo de scores y herramientas tales como índices de oxigenación, estudios radiológicos y valoración hemodinámica.
Posterior a la fase crítica deben tenerse en cuenta complicaciones de índole neurológicas, cardíacas, respiratorias y nutricionales que puedan comprometer nuevamente el estado del paciente. Es necesario establecer un protocolo de tratamiento y evaluación cardiovascular en niños que han sufrido el MIS-C por su alta prevalencia de afecciones cardíacas. La ecocardiografía a la cama del paciente es una herrramienta importante para este fin.
Aspectos éticosDe acuerdo con los principios en la declaración de Helsinki, este reporte de caso se desarrolla conforme a los principios de no maleficiencia y confidencialidad, ya que no se divulgan datos de identificación del paciente a quien corresponde el reporte de caso.
- The Novel Coronavirus Pneumonia Emergency Response Epidemilogy Team. The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) China CDC. 2020. Disponible en: http://weekly.chinacdc.cn/fileCCDCW/ journal/article/ccdcw/2020/8/PDF/ COVID-19.pdf
- Newland JG, Bryant KA. Children in the eye of the pandemic storm-Lessons from New York City. JAMA Pediatr. 2020;174(10):e202438. DOI: 10.1001/jamapediatrics.2020.2438
- Garazzino S. Multicentre Italian study of SARS-CoV-2 infection in children and adolescents, prelimnary data as at 10 April 2020. Eurosurveillance. 2020;25(18):2-5, DOI: 10.2807/1560-7917.ES.2020.25.18.2000600
- Dong Y. Epidemiology of COVID 19 among children in China. Pediatrics. 2020; e20200702. DOI: 10.1542/peds.2020-0702
- Hoang A. COVID-19 in 7780 pediatric patients: A systematic review. EClnicalMedicine. 2020;100433. DOI: 10.1016/j.eclinm.2020.100433
- Pourbagheri-Sigaroodi A. Laboratory findings in COVID-19 diagnosis and prognosis. Clinica Chimica Acta. 2020; 510:475-482. DOI: 10.1016/j.cca. 2020.08.019
- Cheung KS. Gastrointestinal manifestations of SARS-COV-2 infection and virus load in fecal samples from the Hong Kong cohort and systematic review and meta-analysis. Gastroenterology. 2020. DOI: 10.1053/j. gastro.2020.03.065
- Health Department-Reported Cases of Multisystem Inflammatory Syndrome in Children (MIS-C) in the United States [Internet]. Center for Disease Control and prevention. 2021 [citado 8 mayo 2021]. Disponible en: https://www.cdc.gov/mis-c/ cases/index.html
- Katal S. Imaging Findigns of SARS-CoV-2 Infection in Pediatrics: a systematic review of coronavirus disease 2019 (COVID-19) in 850 Patients. Acad Radiol. 2020;27 (11):16081621
- Riphagen S. Hyperinflammatory shock in children during COVID-19 pandemic. The Lancet. 2020;395(10237):1607–8. DOI: 10.1016/S0140- 6736(20)31094-1
- Zhang M-M. Clinical analysis of Kawasaki disease shock syndrome. Chin Med J. 2017;130(23):2891–2. DOI: 10.4103/0366- 6999.219151
- Whittaker E. Clinical Characteristics of 58 Children With a Pediatric Inflammatory Multisystem Syndrome Temporally Associated With SARS-CoV-2. JAMA. 2020;324(3):259-269. DOI: 10.1001/ jama.2020.10369
- Feldstein LR. Multisystem inflammatory syndrome in U.S. children and adolescents. N Engl J Med 2020;383:334-346. DOI: 10.1056/NEJMoa2021680
- Antúnez-Montes OY. COVID-19 and multisystem inflammatory syndrome in Latin American children. Pediatr Infect Dis J. 2021;40(1):e1-e6. DOI: 10.1097/INF.0000000000002949
- Ulloa-Gutierrez R. Multisystem Inflammatory Syndrome Surveillance and COVID-19 in Latin America. Pediatr Infect Dis J. 2020;39(12):e473-e474. DOI: 10.1097/inf.0000000000002949
- Godfred-Cato S. COVID-19-associated multisystem inflammatory syndrome in children – United States, March-July 2020. MMWR. 2020;69(32):1074–1080. Disponible en: https://www.cdc.gov/mmwr/ volumes/69/wr/mm6932e2.htm
- Centers for Disease Control and Prevention. Multisystem Inflammatory Syndrome (MIS-C). Case Definition for MIS-C. Centers for Disease Control and Prevention. 2020. Consultado del 4 de marzo de 2021. Disponible en: https://www.cdc.gov/mis-c/ hcp/index.html
- American Academy of Pediatrics. Multisystem Inflammatory Syndrome in Children (MIS-C) Interim Guidance. American Academy of Pediatrics. 2020. Consultado el 1 de marzo de 2021. Disponible en: https://www.aap.org/en/pages/2019-novel-coronavirus-covid-19-infections/clinical-guidance/multisystem-inflammatory-syndrome-in-children-mis-c-interim-guidance/
- Grasselli G, Tonetti T, Protti A, Langer T, Girardis M, Bellani G, et al. Pathophysiology of COVID-19-associated acute respiratory distress syndrome: a multicentre prospective observational study. Lancet Respir Med. 2020;8(12):1201–8.
- Ouldali N, Toubiana J, Antona D, et al. Association of intravenous Immunoglobulins Plus Methylprednisolone vs Immunoglobulins alone with course of fever in Multisystem inflammatory syndrome in children. JAMA. 2021;325 (9):855-864. DOI: 10.1001/ jama.2021.0694
Citación recomendada: Escalante Prieto E, Guzmán L, Barahona G, Castillo D. Síndrome inflamatorio multisistemico en niños asociado a infección por SARS- COV- 2. Alerta.2021;4(2):12-19. DOI: 10.5377/alerta.v4i2.10905









