
Resumen
Se presenta el caso de un lactante masculino de tres meses de edad, quien desarrolló neumonía por SARS-CoV-2, sin nexo epidemiológico identificado. Estuvo ingresado en un inicio en el Hospital Nacional de la Unión y luego, por persistencia de la fiebre, fue trasladado al Hospital Nacional San Juan de Dios de San Miguel, donde se le realizaron los diagnósticos de bronconeumonía, broncoespasmo y laringotraqueobronquitis (Crup). Se le diagnosticó infección por SARS-CoV-2 mediante RT-PCR. La intervención terapéutica consistió en tratamiento con oxacilina, ceftriaxona y nebulizaciones con salbutamol, alternadas con epinefrina; se le agregó claritromicina por la posibilidad de un síndrome coqueluchoide. Ante el resultado positivo de la RT-PCR a COVID-19, previo consentimiento informado y firmado de la madre, se le inició lopinavir-ritonavir, ivermectina y enoxaparina sódica. La evolución clínica fue satisfactoria y se le dio el alta después de cumplir 8 días con oxacilina y 4 días con ceftriaxona, además de cumplir con el protocolo de manejo contra COVID-19. Se continuó el manejo ambulatorio con amoxicilina más ácido clavulánico, acetaminofén, zinc y salbutamol en aerosol.
Three-month-old male infant who developed SARS-CoV-2 pneumonia without an identified epidemiological link. Initially admitted to Hospital Nacional de la Unión, and then, due to persistent fever, he was transferred to Hospital Nacional San Juan de Dios de San Miguel, where he was diagnosed with bronchopneumonia, bronchospasm, and laryngotracheobronchitis (Croup). SARS-CoV-2 RT-PCR yielded a positive result. Treated with oxacillin and ceftriaxone, plus salbutamol and epinephrine alternated mists; clarithromycin was added due to the possibility of Coqueluchoid Syndrome. Once the positive RT-PCR result for COVID-19 was known, previous informed and signed consent by his mother, he received lopinavir / ritonavir, ivermectin, and sodium enoxaparin. Given his satisfactory clinical evolution, the patient was discharged after completing 8 days with oxacillin and 4 days with ceftriaxone, in addition to the protocol against COVID-19. Outpatient management continued with amoxicillin clavulanate, acetaminophen, zinc, and salbutamol mists.
Introducción
Los niños y adolescentes pueden infectarse por SARS-CoV-2. Muchos de ellos no presentan síntomas. Aquellos que enferman, tienden a experimentar síntomas más leves que en los adultos, como fiebre baja, fatiga y tos. Las tasas de hospitalización en los niños son significativamente más bajas que las tasas de hospitalización en los adultos con COVID-19. Los niños con patologías subyacentes (obesidad, cardiopatías, inmunosupresión, cáncer, diabetes), tienen un mayor riesgo de desarrollar cuadros graves de COVID-191-5.
Se desconoce la verdadera incidencia de la infección por SARS-CoV-2 en niños. Lo anterior se debe a las siguientes razones: hay casos asintomáticos, la mayoría de los casos en pediatría son leves por lo que no levantan sospecha de la enfermedad, y se priorizan las pruebas en los adultos. Asintomáticos o levemente sintomáticos, los niños excretan al virus a través de sus secreciones respiratorias y sus heces por tiempo prolongado, contribuyendo a la diseminación del virus en la comunidad6-9.
La falta de casos pediátricos dificulta hacer diagnóstico clínico en niños. Este reporte describe el caso de un lactante de tres meses con neumonía por COVID-19, probablemente con una infección bacteriana sobreagregada; este es uno de los pacientes más jóvenes tratados por infección por SARS-CoV-2, en el Hospital Nacional San Juan de Dios de San Miguel (HNSJDSM). Se describen las características clínicas, resultados de laboratorio, imágenes de rayos X y el tratamiento.
Presentación del caso 4/6/20Se trata de un paciente masculino de tres meses de edad, procedente del cantón El Caulotillo del municipio El Carmen, departamento de La Unión, quien consultó el 4/6/20 al Hospital Nacional de la Unión (HNLU) por «la fiebre», con historia de 11 días de haber iniciado fiebre, tos húmeda, no emetizante ni cianozante y con dificultad respiratoria. Fue evaluado e ingresado con diagnóstico de neumonía. Presentaba como antecedentes personales un esquema de vacunación incompleto (falta la vacuna inactivada contra la polio), llevaba los controles infantiles en la Unidad Comunitaria de Salud Familiar el Carmen, La Unión. Se ingresó a los 11 días de vida por ictericia neonatal sin ninguna otra complicación. No tenía alergias conocidas y la madre niega al interrogatorio antecedentes de contactos respiratorios o febriles en los últimos catorce días. Ambos padres permanecieron asintomáticos durante el proceso febril del lactante.
Evolución clínica en el HNLU 5/6/20Por las características del cuadro clínico y persistencia de la fiebre, se tomó prueba RTPCR para SARS-CoV-2 el 5/6/2020, con resultado negativo. Se manejó inicialmente con ceftriaxona como monoterapia por cinco días, con poca mejoría, por lo que se agregaron oxacilina, metilprednisolona y nebulizaciones con salbutamol. Los exámenes tomados durante su estancia en el HNLU se presentan en la Tabla 1. La radiografía de tórax tomada durante su ingreso mostraba infiltrados inflamatorios parahiliares, bilaterales, leves, a predominio derecho (Figura 1).
12/6/20Después de ocho días de ingreso, presentó nuevamente elevación de la temperatura, sibilancias y tirajes intercostales, por lo que se refirió al Hospital Nacional San Juan de Dios de San Miguel.
Evolución clínica en el HNSJDSM12/6/20Se recibió al recien nacido en la unidad de emergencia con FC: 178/minuto, FR: 60/minuto, T: 37,4 o C, SAT O2 : 97 % al aire ambiente, con un peso de 6,3 kg. Al examen físico, activo, irritable, afebril, rosado, mucosas húmedas. Cabeza: normo cráneo, fontanela anterior normo tensa, ojos y conductos auditivos externos sin anormalidades, fosas nasales sin aleteo. Cuello: simétrico, sin anormalidades. Tórax: pulmones ventilados con estridor inspiratorio audible sin estetoscopio, roncus, sibilancias y estertores crepitantes, bilaterales. Cardiovascular: ritmo regular, no soplos. Abdomen: globoso con peristalsis presente y normal, no hepatomegalia ni esplenomegalia. Genitales: masculinos, sin anormalidades. Extremidades: normotróficas, normotónicas, llenado capilar menor a tres segundos, pulsos periféricos presentes y normales.
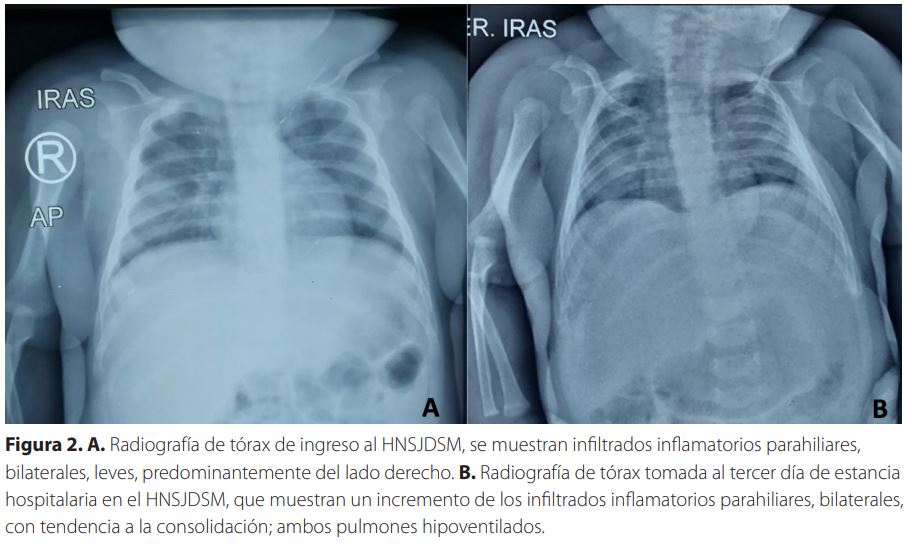
Diagnóstico clínicoDespués de la evaluación clínica se diagnosticó neumonía, broncoespasmo y laringotraqueobronquitis (Crup). Se ingresó al paciente con alimentación por seno materno o sucedáneos, medidas generales, sello de heparina, oxacilina 200 mg/kg/día IV cada 6 horas, dexametasona 1mg IV cada 6 horas, nebulizaciones con salbutamol alternadas con epinefrina, acetaminofén, exámenes (reportados en la Tabla 2), incluyendo una nueva RT-PCR. La placa de tórax de ingreso mostraba infiltrados inflamatorios parahiliares, bilaterales, moderados, a predominio derecho (Figura 2).
Intervención terapéutica 13/6/20Se reportó RT-PCR para SARS-CoV-2 positiva. Previo consentimiento informado firmado por la madre, se agregó lopinavir/ritonavir vía oral cada 12 horas por 7 días; ivermectina a 0.03 mg/kg vía oral cada día por dos días; enoxaparina sódica vía subcutánea cada día por 3 días; zinc vía oral cada día por 7 días y claritromicina vía oral cada 12 horas por 7 días. Esta última por la posibilidad de un síndrome coqueluchoide debido a la tos perruna, la trombocitosis y la edad.
15/6/20Se tomó una placa de tórax de control, donde se observó un incremento de los infiltrados inflamatorios parahiliares, bilaterales, con tendencia a la consolidación; ambos pulmones hipoventilados (Figura 2). Se agregó ceftriaxona 100 mg/kg/día IV cada 12 horas. Se le tomarón exámenes de control en esta fecha y se repitieron de nuevo el 17/6/20 (Tabla 2). La evolución del paciente del 15 al 19 de junio de 2020 fue positiva.
 19/6/20
19/6/20
El paciente cumplió 7 días de tratamiento y se le dio el alta con buen estado general, examen físico sin anormalidades, descenso del leucograma y mejoría radiológica. Cumplió 7 días con oxacilina y 4 días con ceftriaxona, ambos por vía intravenosa, además del protocolo contra COVID-19. Se continuó el manejo ambulatorio por vía oral con amoxicilina más ácido clavulánico, acetaminofén y zinc, así como salbutamol en aerosol.
DiscusiónLos ingresos pediátricos por COVID-19 son esporádicos. Diferentes estudios efectuados desde el inicio de la pandemia han reportado que entre menor la edad, menor la cantidad de ingresos por COVID-19, y a la vez, menor la gravedad del cuadro clínico por el cual ingresan10-12. Sin embargo, otros estudios como los efectuados por Dong et al. 5 y los CDC de Atlanta13, describen que los lactantes menores de un año fueron los que presentaron casos de mayor gravedad. En lo referente al nexo epidemiológico, ninguno de sus padres o familiares cercanos presentó en los últimos catorce días antes del ingreso, sintomatología compatible con COVID-19. El período de incubación de COVID-19 suele ser de 1 a 14 días, con un promedio de 5,2 días14. Estudios efectuados en pacientes pediátricos15,16 han reportado que los niños a menudo tienen una enfermedad leve, con fiebre y tos como los principales hallazgos clínicos. La sintomatología más frecuente en neonatos y lactantes es distrés respiratorio, generalmente secundario a una neumonía17. Este paciente desarrolló una neumonía moderada por SARS-CoV-2.
Las pautas nacionales chinas para el diagnóstico y el tratamiento de COVID-1918, establecen que es común que los pacientestengan un recuento de leucocitos normal o disminuido, linfopenia y trombocitopenia, así como un aumento de leve a moderado de la ALT y la AST. Sin embargo, los hallazgos del leucograma del paciente no son los que se han reportado en la literatura mundial: no presentó linfopenia y presentó trombocitosis, esta última se ha reportado esporádicamente en COVID-19. La ALT y AST presentaron elevación moderada, tal como se describe en otros estudios19. La evolución del paciente fue acorde a lo descrito en casos clínicos de esta índole: evolución favorable ante la ausencia de comorbilidades13/sup>.
Los pacientes menores de 18 años pueden ser evaluados de acuerdo a las pautas de puntuación para pacientes pediátricos con COVID-19, emitidas por la Sociedad de Pediatría de la Asociación Médica China20,21. Han definido la gravedad de COVID-19 sobre la base de características clínicas, pruebas de laboratorio e imagenología, incluyendo la infección asintomática y los casos leve, moderado, grave y crítico. Los criterios de diagnóstico son los siguientes: 1. Infección asintomática: ningún síntoma o signo clínico y las imágenes de tórax normales, RT-PCR o serología positivos. 2. Caso leve: sintomatología de infección aguda del tracto respiratorio superior, incluyendo: fiebre, fatiga, mialgia, tos, dolor de garganta, secreción nasal y estornudos. El examen físico revela faringitis y ausencia de sonidos anormales en los pulmones. Algunos niños pueden no tener fiebre o tener solo síntomas gastrointestinales como náuseas, vómitos, dolor abdominal y/o diarrea. 3. Caso moderado: paciente con Caso moderado: paciente con Caso moderado: paciente con neumonía, fiebre y tos (tos seca al principio, seguida de tos con flema); algunos pueden presentar sibilancias, pero no hipoxemia o dificultad para respirar. En los pulmones se pueden escuchar estertores secos y/o húmedos. Algunos casos no tienen síntomas ni signos clínicos, pero la tomografía axial computarizada de tórax revela lesiones pulmonares, que son subclínicas. 4. Caso grave: síntomas respiratorios tempranos, como fiebre y tos; pueden acompañarse de síntomas gastrointestinales como diarrea. A menudo progresan en aproximadamente una semana, desarrollando neumonía con disnea y cianosis central. La saturación de oxígeno es < 92 %, acompañándose de otras manifestaciones de hipoxia. 5. Caso crítico: los niños pueden progresar rápidamente a síndrome de dificultad respiratoria aguda (SDRA) o falla respiratoria y también pueden presentar: choque, encefalopatía, insuficiencia cardíaca, insuficiencia renal aguda y/o coagulopatías. La disfunción orgánica puede ser mortal.
Con base en la clasificación de gravedad pediátrica descrita, el paciente en discusión presentó un caso moderado de COVID-19; probablemente con una infección bacteriana sobreagregada, tomando en cuenta su evolución clínica favorable al agregar clindamicina y ceftriaxona al esquema terapéutico.
AgradecimientoA la Dirección del Hospital Nacional San Juan de Dios de San Miguel, por su anuencia para la realización de este reporte de caso clínico.
FinanciamientoEl estudio fue financiado por cada autor
- The Novel Coronavirus Pneumonia Emergency Response Epidemiology Team. The epidemiological characteristics of anoutbreak of 2019 novel coronavirus diseases (COVID-19). China CDC. 2020. Disponible en: http://weekly.chinacdc.cn/fileCCDCW/journal/article/ccdcw/2020/8/PDF/COVID-19.pdf
- Newland JG, Bryant KA. Children in the eye of the pandemic storm—lessons from New York City. JAMA Pediatr. 2020;e202438. DOI: 10.1001/jamapediatrics.2020.2438
- Garazzino S, Montagnani C, Doná D, Meini A, Felici E, Vergine G, et al. Multicentre Italian study of SARS-CoV-2 infection in children and adolescents, preliminary data as at 10 April 2020. Eurosurveillance. 2020; 25(18). DOI: 10.2807/1560-7917. ES.2020.25.18.2000600
- Korea Centers for Disease Control and Prevention. COVID-19 National Emergency Response Center, Epidemiology and Case Management Team. Coronavirus Disease-19: The first 7,755 cases in the Republic of Korea. Osong Public Health Res Perspect. 2020;11(2):85–90. DOI: 10.24171/j. phrp.2020.11.2.05
- Dong Y, Mo X, Hu Y, Qi X, Jiang F, Jiang Z, et al. Epidemiology of COVID-19 among children in China. Pediatrics. 2020;e20200702. DOI: 10.1542/peds.2020-0702
- Cai J, Xu J, Lin D, Yang zhi, Xu L, Qu Z, et al. A Case series of children with 2019 novel coronavirus infection: clinical and epidemiological features. Clin Infect Dis. 2020;ciaa198. DOI: 10.1093/cid/ciaa198
- Cheung KS, Hung IFN, Chan PPY, Lung KC, Tso E, Liu R, et al. Gastrointestinal manifestations of SARS-CoV-2 infection and virus load in fecal samples from the Hong Kong cohort and systematic review and meta-analysis. Gastroenterology. 2020; DOI: 10.1053/j.gastro.2020.03.065
- Passanisi S, Lombardo F, Salzano G, Pajno GB. Are children most of the submerged part of SARS-CoV-2 iceberg? Front Pediatr. 2020;8:213. DOI: 10.3389/fped.2020.00213
- Cruz AT, Zeichner SL. COVID-19 in children: initial characterization of the pediatric disease. Pediatrics. 2020;e20200834. DOI: 10.1542/peds.2020-0834
- Parri N, Lenge M, Buonsenso D. Children with Covid-19 in pediatric emergency departments in Italy. N Engl J Med. 2020. DOI: 10.1056/NEJMc2007617 11. Parri N.
- Parri N. Supplementary appendix to: Parri N, Lenge M, Buonsenso D. Children with Covid-19 in pediatric emergency departments in Italy. N Engl J Med. 2020; 383:187-190. Disponible en: https://www.nejm.org/doi/suppl/10.1056/NEJMc2007617/suppl_file/nejmc2007617_appendix.pdf
- Wei M. Novel Coronavirus Infection in Hospitalized Infants Under 1 Year of Age in China. JAMA. 2020;323(13):1313-1314.DOI: 10.1001/jama.2020.2131
- . Centers for Disease Control and Prevention. COVID-19 Response Team. Coronavirus disease 2019 in children — United States, February 12–April 2, 2020. Morbidity and Mortality Weekly Report 422 MMWR. 2020;69(14):422–6. Disponible en: https://www.cdc.gov/mmwr/volumes/69/wr/pdfs/mm6914e4-H.pdf
- . Special Expert Group for Control of the Epidemic of Novel Coronavirus Pneumonia of the Chinese Preventive Medicine Association. An update on the epidemiological characteristics of novel Alerta. 2021;4(2):5-10 Lactante de 3 meses de vida con neumonía por SARS-CoV-2 10 coronavirus pneumonia (COVID-19). Chin J Epidemiol 2020;4(2):139-144. DOI: 10.3760/cma.j.issn.0254-6450.2020.02.002
- Wang XF. Clinical and epidemiological characteristics of 34 children with 2019 novel coronavirus infection in Shenzhen. Chin J Pedriatr. 2020;58:E008. DOI: 10.3760/cma.j.issn.0578-1310.2020.0008
- Qiu H, Wu J, Hong L, Luo Y, Song Q, Chen D. Clinical and epidemiological features of 36 children with coronavirus disease 2019 (COVID-19) in Zhejiang, China: an observational cohort study. Lancet Infect Dis. 2020;20(6):689–96. DOI: 10.1016/S1473-3099(20)30198-5
- Zimmermann P. COVID-19 in Children, Pregnancy and Neonates: A Review of Epidemiologic and Clinical Features. Pediatr Infect Dis J. 2020;39: 469–477. DOI: 10.1097/INF.0000000000002700
- National Health Commission & State Administration of Traditional Chinese Medicine. Diagnosis and treatment protocol for novel coronavirus pneumonia (Trial Version 7). National Health Commission of the People’s Republic of China. 2020. Disponible en: http://www.kankyokansen.org/uploads/uploads/files/jsipc/protocol_V7.pdf
- Cai Q, Huang D, Yu H, Zhu Z, Xia Z, Su Y, et al. COVID-19: Abnormal liver function tests. J. Hepatol. 2020;73(3):566–574. DOI: 10.1016/j.jhep.2020.04.006. Epub 2020 Apr 13. PMID: 32298767; PMCID: PMC7194951.
- Society of Pediatrics, Chinese Medical Association; Editorial Board, Chinese Journal of Pediatrics. [Recommendations for the diagnosis, prevention and control of the 2019 novel coronavirus infection in children (first interim edition)]. Zhonghua Er Ke Za Zhi. 2020 Mar 2;58(3):169-174. Chinese. DOI: 10.3760/cma.j.issn.0578-1310.2020.03.001. PMID: 32135584.
- Souza TH, Nadal JA, Nogueira RJN, Pereira RM, Brandão MB. Clinical manifestations of children with COVID-19: A systematic review. Pediatr. Pulmonol. 2020;55(8):1892– 1899. DOI: 10.1002/ppul.24885
Citación recomendada: Oliva Marín JE, Martínez García JA. Lactante de 3 meses de vida con neumonía por SARS-CoV-2. Alerta. 2021;4(2): DOI: 10.5377/alerta.v4i2.10047












