
Resumen
Introducción. La enfermedad de Chagas es una infección causada por el parásito Trypanosoma cruzi y transmitida por el vector Triatoma dimidiata, conocido en El Salvador como «chinche picuda». Esta enfermedad siempre ha sido de interés científico en modelos animales. Objetivo. Identificar el efecto de la infección por Trypanosoma cruzi en ratones de diferentes cepas (BALB/c y NIH) y sexo. Metodología. Se establecieron ocho grupos: cuatro infectados con Trypanosoma cruzi y cuatro grupos no infectados, distribuidos por cepa y sexo, con cinco ratones por grupo. Durante seis semanas se registró el peso corporal de los ratones. Además, se prepararon muestras de sangre de los grupos infectados en láminas para realizar los conteos de parasitemia. Al final del estudio, se extrajeron el bazo y el corazón de ambos grupos para los análisis estadísticos. Resultados. Los grupos infectados mostraron un incremento de peso en comparación a sus grupos controles. En la cepa NIH, las hembras presentaron una mayor parasitemia, mientras que en la cepa BALB/c fueron los machos los de mayor parasitemia. Los órganos de los grupos infectados fueron significativamente más grandes comparados a los de los grupos de control, excepto en el corazón de la cepa BALB/c. Respecto al peso de los órganos, se observaron diferencias significativas únicamente en el corazón de los machos de la cepa BALB/c, mientras que en el bazo ocurrió lo contrario. Conclusión. Los machos de la cepa BALB/c son más susceptibles al Trypanosoma cruzi, presentando niveles de parasitemia más altos entre los grupos estudiados.
Effects of Trypanosoma cruzi infection in Balb/c and NIH mouse strains
Introduction. Chagas disease is an infection caused by the parasite Trypanosoma cruzi and transmitted by the vector Triatoma dimidiata, known in El Salvador as “chinche picuda”. This disease has always been of scientific interest in animal models. Objective. Identify the effect of Trypanozoma cruzi infection in mice of different strains (BALB/c and NIH) and sex. Methodology. Eight groups were established: four infected with Trypanosoma cruzi and four uninfected groups, distributed by strain and sex, with five mice per group. The body weight of the mice was recorded for six weeks. In addition, blood samples from the infected groups were prepared on slides for parasitemia counts. At the end of the study, the spleen and heart were extracted from both groups for statistical analyses. Results. The infected groups showed an increase in weight compared to their control groups. In the NIH strain, females had higher parasitemia, whereas in the BALB/c strain, males had higher parasitemia. The organs of the infected groups were significantly larger compared to those of the control groups, except in the heart of the BALB/c strain. Regarding organ weight, significant differences were observed only in the heart of the male BALB/c strain, while the opposite was true for the spleen. Conclusion. Males of the BALB/c strain are more susceptible to Trypanosoma cruzi, presenting higher levels of parasitemia among the groups studied.
Introducción
El protozoario flagelado Trypanosoma cruzi (T. cruzi) es el agente causal de la tripanosomiasis americana o enfermedad de Chagas, una enfermedad de importancia en salud pública que persiste como endémica en extensas zonas de América Latina. La transmisión ocurre principalmente por medio de vectores triatominos, insectos hematófagos nocturnos pertenecientes a la subfamilia Triatominae del orden Hemiptera, familia Reduviidae, que se alimentan de sangre de mamíferosi.
Los reservorios naturales lo constituyen armadillos, marsupiales, roedores murciélagos y primates silvestres, además de animales domésticos como perros y gatos, siendo el parásito aislado en más de 150 especies de mamíferos domésticos y salvajesii.
El ciclo biológico de T. cruzi es complejo, involucra la transmisión por insectos vectores y la infección de hospedadores vertebrados, la mayoría de los cuales son mamíferos, incluido el humano, que es un hospedero susceptibleiii.
Comprender la fisiopatología de la infección por T. cruzi en animales de laboratorio es un logro significativo para el estudio de la enfermedad de Chagas. Los modelos experimentales controlados permiten analizar de diferentes parámetros relacionados con el huésped y el parásito, aspectos que no pueden ser abordados en humanos por razones éticasiv,v.
La mayoría de los estudios de la fase aguda de la enfermedad se realizan en modelos animales, ya que esta fase de la enfermedad, generalmente en humanos, pasa desapercibida por ser autolimitada y con manifestaciones clínicas inespecíficas, lo que conlleva a la mayor parte de los casos a no ser diagnosticados. El modelo más utilizado para estudiar esta enfermedad es el ratón de laboratorio, debido a que es una de las especies mejor estudiadas desde el punto de vista inmunológico. La infección aguda experimental progresa de manera diferente según la cepa del parásito, cepa del ratón, la virulencia, la dosis de inoculación, número de parásitos, la edad, el sexo y el perfil genético, entre otros factoresv,vi,vii. Las cepas patógenas de Trypanosoma cruzi generalmente provocan una enfermedad aguda y una alta mortalidad en cepas susceptibles de ratones, aunque estos modelos se consideran representaciones precisas del proceso de infección en humanos. Sin embargo, son cruciales para investigar las respuestas inmunitarias, los estados endocrinos, metabólicos y sus interacciones, dado que en humanos esta etapa aguda pasa desapercibida, salvo en casos de infección oralvii.
Diversas cepas de ratones difieren en la susceptibilidad o resistencia a la infección, evidenciando un complejo control genético de los niveles de parasitemia y la supervivencia de los animales infectadosviii,ix,x. Por lo tanto, en este estudio se evaluó el efecto de la infección por Trypanosoma cruzi en ratones de diferentes cepas (BALB/c y NIH) y sexo.
Metodología
Diseño experimental
Se utilizaron en total 40 ratones sanos, los cuales fueron evaluados mediante chequeos clínicos basados en apariencia del pelaje, ojos, piel y algunas mucosas. Se establecieron ocho grupos, cada uno compuesto por cinco ratones: cuatro grupos fueron infectados con parásitos (casos) y cuatro grupos se mantuvieron sanos (controles). Los grupos fueron distribuidos según la cepa (NIH y BALB/c) y el sexo (Tabla 1).
Al grupo control se le evaluó el peso corporal, el tamaño y el peso del corazón y del bazo; además todos los ratones fueron seleccionados al azar y contaban con una edad aproximada de entre cinco a seis semanas de nacidos. La duración del estudio fue de seis semanas, durante las cuales la primera semana fue de inoculación del parásito y las cinco semanas posteriores para el conteo de parasitemia dos veces a la semana. Se realizaron diez evaluaciones a cada uno de los ratones infectados, para las evaluaciones se utilizó el microscopio marca Leica.
En El Salvador, actualmente no existe un comité de ética para el uso de animales de laboratorio; no obstante, el estudio fue realizado bajo las normas internacionales ARRIVExi.
| Grupo | Peso Inicial | Peso final | Aumento % | Valor p |
| NIH (hembras) Control | 24,63 ± 2,62 | 26,93 ± 2,50 | 9,56 ± 5,06 | – |
| NIH (hembras) Infectadas | 22,94 ± 2,21 | 28,44 ± 2,29 | 24,22 ± 5,70 | 0,005* |
| NIH (machos) Control | 26,60 ± 5,23 | 31,08 ± 5,63 | 17,17 ± 4,53 | – |
| NIH (machos) Infectados | 22,15 ± 7,64 | 33,43 ± 4,16 | 60,49 ± 18,64 | 0,102 |
| BALB/c (hembras) Control | 24,40 ± 0,87 | 27,63 ± 0,85 | 13,33 ± 5,65 | – |
| BALB/c (hembras) Infectadas | 27,08 ± 0,93 | 33,24 ± 1,37 | 22,80 ± 4,84 | 0,030* |
| BALB/c (machos) Control | 21,78 ± 0,77 | 28,98 ± 0,81 | 33,20 ± 6,04 | – |
| BALB/c (machos) Infectados | 17,32 ± 0.83 | 30,10 ± 2,96 | 73,69 ± 13,08 | 0,001* |
Los valores se expresan como la media ± la desviación estándar. Las diferencias significativas entre los grupos se expresan cuando *p < 0,05. Peso expresado en gramos.
Obtención del parásito
Los parásitos de Trypanosoma cruzi en su etapa de tripomastigotes metacíclicos se obtuvieron mediante una muestra de heces del vector Triatoma dimidiata (chinche picuda) recolectadas en el cantón Huisiltepeque, municipio de Tenancingo, departamento de Cuscatlán, El Salvador. Las heces del vector se diluyeron en 0,5 mL de solución salina normal al 0,9 % y se verificó la presencia del Trypanosoma cruzi mediante observación directa utilizando un microscopio de campo claro. Esta preparación fue proporcionada por el Laboratorio de Entomología de Vectores del Centro de Investigación y Desarrollo en Salud de la Universidad de El Salvador.
Animales experimentales
Se utilizaron ratones de las cepas NIH y BALB/c, procedentes del Laboratorio de Experimentación Animal del Centro de Investigación y Desarrollo en Salud de la Universidad de El Salvador. Los ratones fueron alimentados con una dieta de concentrado peletizado para roedores marca Tecnutral y acceso libre a agua. Todos los animales se mantuvieron a una temperatura de 22 ± 2 °C y a una humedad relativa controlada entre el 50 - 60 %, con un ciclo luz – oscuridad de 12/12 horas. Para la identificación individual, fueron marcados individualmente con ácido pícrico.
Inoculación del parásito
Se identificó al ratón con mayor parasitemia (tripomastigotes sanguíneos) y se le extrajo sangre de la vena submandibular para obtener 1 ×105 parásitos/mL en solución salina. Esta cantidad fue necesaria para infectar a los ratones. Posteriormente, se sujetaron e inmovilizaron los ratones y se les inoculó por vía intraperitoneal 1 × 104 parásitos/0,1 mL de la solución preparada anteriormente a cada ratón, utilizando una jeringa de tuberculina de 1 mL. Se empleó la siguiente fórmula para calcular la cantidad de parásitos requerida para alcanzar la infecciónxii, donde:
C1: 1 × 105 parásitos
V1: 1 mL de solución salina normal al 0,9 %
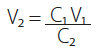
C2: Cantidad de parásitos del ratón infectado
V2: Cantidad de sangre que se necesita
Peso corporal
Se registró el peso corporal en gramos inicial de todos los grupos utilizandola balanza marca COBOS antes de la inoculación del parásito. Y posteriormente, se realizó el pesaje una vez por semana hasta finalizar el experimento.
Conteo de parásitos
Para realizar el conteo se extrajo una muestra de sangre de aproximadamente 10 µL de la cola de cada ratón infectado. Luego, se tomaron 5 µL de sangre con una micropipeta Accumax®, los cuales fueron depositados en un portaobjeto y cubiertos inmediatamente con un cubreobjeto para obtener una capa delgada y homogénea. Posteriormente, se llevó al microscopio para su observación en 40x y se procedió a efectuar un recuento de parásitos en 50 campos, contando de izquierda a derecha y viceversa.
Tamaño y peso de órganos
Una vez finalizados los conteos de parasitemia, a todos los grupos de animales se les aplicó el método eutanásico de dislocación cervical, se extrajeron los órganos (corazón y bazo) para poder evaluar la apariencia, el tamaño (medido en centímetros) y el peso (medido en gramos) en el momento.
Análisis estadístico
Para el análisis estadístico de los datos se utilizaron los programas IBM® SPSS 21 y Microsoft Excel 365. Para el peso corporal y de órganos se realizó la prueba de T Student, y para el conteo de los parásitos un Análisis de Varianza (ANOVA) de una vía. La diferencia entre los grupos experimentales se consideró como significativa cuando p < 0,05. La mayoría de resultados son expresados con la Media ± la Desviación Estándar.
Resultados
Peso corporal
En la Tabla 1 se indica que los grupos con Trypanosoma cruzi obtuvieron un mayor aumento porcentual en el peso corporal en comparación a sus grupos controles (ratones no infectados), teniendo la mayoría un valor p < 0,05 excepto el grupo de machos de la cepa NIH que obtuvo un valor p = 0,102.
Conteo de parásitos
Los ratones infectados con T. cruzi de las cepas NIH y BALB/c presentaron distintos resultados en cuanto al sexo, reflejado en la Tabla 2 y en la Figura 1. Todos los grupos de ratones evaluados sobrevivieron hasta el final del estudio. El punto máximo de la parasitemia se presentó en el conteo siete y ocho.
En la Figura 1-A se compara gráficamente la cantidad de parásitos observados durante la investigación. En la cepa NIH se puede ver que el grupo de hembras presentó una mayor parasitemia a través del tiempo teniendo su punto máximo en el conteo siete de parásitos. Mientras que en la Figura 1-B se observa a la cepa BALB/c, donde los machos presentaron la mayor parasitemia llegando a su máximo en el séptimo conteo de parásitos.
| Grupos/Conteo | NIH (hembras) | NIH (machos) | BALB/c (hembras) | BALB/c (machos) |
| 1 | 0 | 5,00E+04 | 0 | 3,00E+05 |
| 2 | 0 | 5,00E+04 | 7,50E+04 | 4,00E+05 |
| 3 | 1,50E+05 | 5,00E+04 | 5,00E+04 | 3,00E+05 |
| 4 | 7,50E+05 | 1,00E+05 | 1,25E+05 | 8,75E+05 |
| 5 | 7,50E+05 | 3,00E+05 | 1,00E+05 | 1,60E+06 |
| 6 | 7,50E+05 | 3,50E+05 | 2,00E+05 | 1,10E+06 |
| 7 | 7,50E+05 | 5,00E+05 | 1,50E+05 | 2,20E+06 |
| 8 | 7,50E+05 | 8,00E+05 | 4,75E+05 | 1,10E+06 |
| 9 | 7,50E+05 | 3,50E+05 | 2,50E+05 | 1,60E+06 |
| 10 | 7,50E+05 | 1,00E+05 | 1,50E+05 | 6,00E+05 |
Valores expresados en mediana, las diferencias significativas (*) entre los grupos se expresan cuando p < 0,05.
Tamaño y peso de órganos
Una vez finalizado el conteo de parásitos se extrajeron el corazón y el bazo de los ocho grupos de ratones. En la Tabla 3 se puede notar que el tamaño de ambos órganos en los grupos infectados con T. cruzi presentó un aumento al compararlos con sus grupos controles, excepto en el corazón de la cepa BALB/c donde no se obtuvieron diferencias significativas en el tamaño, mientras que en el bazo casi todos presentaron diferencias significativas, con excepción del grupo de machos de la cepa BALB/c que obtuvo un valor p = 0,053 con respecto a su grupo control.
| Órgano | Grupo | Media ± D.E. | Valor p |
| Corazón | NIH (hembras) Control | 0,68 ± 0,17 | |
| NIH (hembras) Infectadas | 0,86 ± 0,09 | 0073 | |
| NIH (machos) Control | 0,87 ± 0,24 | ||
| NIH (machos) Infectados | 0,88 ± 0,08 | 0,966 | |
| BALB/c (hembras) Control | 0,95 ± 0,10 | ||
| BALB/c (hembras) Infectadas | 0,82 ± 0,08 | 0,071 | |
| BALB/c (machos) Control | 1,00 ± 0,08 | ||
| BALB/c (machos) Infectados | 0,94 ± 0,09 | 0,334 | |
| Bazo | NIH (hembras) Control | 1,88 ± 0,15 | |
| NIH (hembras) Infectadas | 2,66 ± 0,15 | 0,000* | |
| NIH (machos) Control | 1,75 ± 0,33 | ||
| NIH (machos) Infectados | 2,48 ± 0,11 | 0,002* | |
| BALB/c (hembras) Control | 2,00 ± 0,08 | ||
| BALB/c (hembras) Infectadas | 2,52 ± 0,13 | 0,000* | |
| BALB/c (machos) Control | 1,73 ± 0,38 | ||
| BALB/c (machos) Infectados | 2,56 ± 0,63 | 0,053 |
Los valores se expresan como la media ± la desviación estándar (D.E.). Las diferencias significativas entre los grupos se expresan cuando *p < 0,05.
El peso de los órganos analizados entre los grupos controles y los infectados se pueden apreciar en la Tabla 4. Mostraron diferencias significativas para el corazón únicamente en el grupo de los machos de la cepa BALB/c con un valor p = 0,008. Por otro lado, en el bazo el único grupo que no presentó diferencias comparado con su control fueron los machos de la cepa BALB/c teniendo un valor p = 0,061, a pesar de tener una media muy alta.
| Órgano | Grupo | Media ± D.E. | Valor p |
| Corazón | NIH (hembras) Control | 0,17 ± 0,01 | |
| NIH (hembras) Infectadas | 0,14 ± 0,03 | 0,060 | |
| NIH (machos) Control | 0,16 ± 0,03 | ||
| NIH (machos) Infectados | 0,14 ± 0,06 | 0,685 | |
| BALB/c (hembras) Control | 0,16 ± 0,04 | ||
| BALB/c (hembras) Infectadas | 0,21 ± 0,03 | 0,076 | |
| BALB/c (machos) Control | 0,20 ± 0,04 | ||
| BALB/c (machos) Infectados | 0,13 ± 0,02 | 0,008* | |
| Bazo | NIH (hembras) Control | 0,13 ± 0,03 | |
| NIH (hembras) Infectadas | 0,37 ± 0,15 | 0,020* | |
| NIH (machos) Control | 0,14 ± 0,02 | ||
| NIH (machos) Infectados | 0,32 ± 0,08 | 0,007* | |
| BALB/c (hembras) Control | 0,13 ± 0,01 | ||
| BALB/c (hembras) Infectadas | 0,38 ± 0,07 | 0,001* | |
| BALB/c (machos) Control | 0,16 ± 0,09 | ||
| BALB/c (machos) Infectados | 0,35 ± 0,16 | 0,061 |
Los valores se expresan como la media ± la desviación estándar (D.E.). Las diferencias significativas entre los grupos se expresan cuando *p < 0,05.
Discusión
El interés fundamental en este estudio fue demostrar la fase aguda de la infección del Trypanosoma cruzi en un modelo animal utilizando ratones de la cepa BALB/c y NIH, después de un período de observación de seis semanas.
Sin embargo, los resultados obtenidos en este estudio contradicen a lo expuesto por otros autoresxiii,xiv,xv,xvi,xvii, quienes han demostrado que la infección con este parásito provoca una disminución estadísticamente significativa en el peso corporal de ratones BALB/c y Cba/j aproximadamente treinta días después de la infecciónxiii,xiv,xv. Esta pérdida de peso se atribuye a una marcada depleción de grasa corporal y un aumento en la retención de agua, sugiriendo que la enfermedad induce una auténtica caquexia, considerándose una de las manifestaciones de la reacción inflamatoria ante dicha infecciónxvi,xvii.
Además, estos estudios señalan que la pérdida de peso se asocia con hipoglucemias pronunciadas y es consecuencia de un proceso multifactorial que incluye también el incremento de citoquinas proinflamatorias, la reducción de la ingesta de alimentos al final de la infección, la afectación hepática provocada por el parásito, dando lugar a deficiencias en la vía gluconeogénica, y la elevada demanda energética provocada por la activación del sistema inmunitarioxv.
La variación en el peso corporal puede ser influenciado inversamente por trastornos metabólicos y desequilibrios hormonales. Entre las principales hormonas que influyen en el peso corporal se incluyen los glucocorticoides, prolactina, dehidroepiandrosterona, hormona del crecimiento, testosterona y leptina. La alteración en la estructura o resistencia a la hormona leptina puede inhibir la saciedad y conducir a un desequilibrio energético que resulta en obesidad, aumentando la susceptibilidad a infecciones e inflamaciónxviii,xix, lo cual podría explicar los hallazgos observados en este estudio.
En relación a la parasitemia los resultados demuestran que en la cepa BALB/c las hembras mostraron mayor resistencia que los machos, presentando un menor número de parásitos en la sangre durante la fase aguda de la enfermedad de Chagas, tal como se ha registrado anteriormentexx. Por el contrario, en los ratones machos de la cepa NIH fueron los más resistentes a la parasitemia.
Es importante destacar que los tripomastigotes sanguíneos de T. cruzi como en esta investigación, se visualizan más rápidamente en comparación cuando son inoculados en su forma metacíclica, obtenida directamente del insecto o de transformaciones realizadas in vitro, como se ha documentado en diferentes estudios con otras cepas de ratonesxxi,xxii. Algunas investigaciones similares mencionan una variedad de patrones en la relación que existe entre el parásito y el hospedador. En este caso los ratones experimentales adquieren la enfermedad por medio de una inoculación establecida o predeterminada y esta puede ser modulada por múltiples variables que dependen del hospedero entre las que tenemos el sexo y la composición genéticaxix. Además, la infección en cepas de ratones de laboratorio puede variar desde cepas altamente resistentes o altamente susceptibles, sugiriendo una base establecida genéticamentevii,xxiii,xxiv. A pesar de las diferentes cepas de ratones y parásitos, está claro que existen múltiples factores que pueden influir en la infección, como el tamaño del inóculo (cantidad de parásitos administrados) y la edad del hospedero, aunque experimentalmente se utilizan jóvenes-adultos para esta clase de modelos in vivovii,xxi.
También se ha demostrado que existen genes implicados en la resistencia o susceptibilidad a la enfermedad, y entre estos los más importantes para determinar la cantidad de parásitos está relacionada con la respuesta del sistema inmunexxv. Se ha documentado que la capacidad de virulencia de T. cruzi para establecer la infección de un hospedero está asociada con la expresión estado-específica de los genes y sus productos polipeptídicos, muchas de estas moléculas son reguladas durante la diferenciación y desarrollo de los diferentes estadíos del parásito que están relacionadas con la evasión de las defensas del hospedadorxxvi,xxvii,xxviii. Entre los factores genéticos asociados a la resistencia o susceptibilidad frente a una variedad de agentes infecciosos son lo que se encuentran habitualmente ligados al Complejo Mayor de Histocompatibilidad (MHC), cuyos genes codifican para proteínas responsables de la inducción en la respuesta inmune contra una variedad de antígenosxxix.
La infección por protozoarios como T. cruzi también suele ser influenciada por el control que pueden ejercer las hormonas sexualesxxx,xxxi. En el caso de las hembras puede ser debido al efecto producido por los estrógenos que se encargan de estimular la actividad fagocítica del macrófago e incrementar la respuesta inflamatoria localxxxii,xxxiii,xxxiv. El desarrollo de la infección con este parásito parece tener diferentes respuestas entre machos y hembras en los modelos murinos, pero en algunos casos el sexo no parece ser determinante en la cantidad de parásitos de los animales infectadosvii. Por otro lado, la defensa del hospedador en contra de la agresión parece depender del estado de desarrollo del sistema inmunitario para ambos sexos y de la estimulación de respuesta de este sistema, actuando posiblemente en asociación con algunos factores hormonales y/o genéticos, pero de manera independientexviii,xx.
En la enfermedad de Chagas algunos de los principales órganos que afecta el parásito en los mamíferos son el corazón y el bazo, y en ocasiones el intestinoxxxv. En esta investigación se reporta que el grupo de hembras BALB/c infectadas mostraron un aumento en el peso del corazón, lo cual es plausible ya que posiblemente el parásito puede estar alojado en el tejido, provocando que el órgano aumente de tamaño. Únicamente hubo un cambio significativo en la disminución del peso del corazón para el grupo de machos de la cepa BALB/c, contrario a lo sucedido con el bazo. En cuanto al tamaño de los órganos, los grupos infectados mostraron un aumento, excepto en el corazón de la cepa BALB/c.
No se encontraron estudios con hallazgos relacionados donde comparen a nivel macroscópico el tamaño y el peso de los órganos afectados debido que directamente se evalúa a nivel microscópico por medio de cortes histológicos, como es el caso de una investigación que mencionan que el aumento del tamaño del corazón puede ser ocasionado por la ablación de las grasas, ya que conduce al estrés del retículo endoplásmico y al estrés oxidativo mitocondrial, provocando dilatación biventricular y aumento de la carga parasitaria en los ratones infectados durante las etapas crónicas tempranas de la infecciónxxxvi. El aumento de tamaño en el bazo puede estar relacionado a un antígeno importante del parásito llamada cruzipaína, el cual incrementa el número de células de este órgano, la granularidad y por lo tanto el tamañoxxxvii. Por otra parte, también se ha demostrado que este antígeno puede ser utilizado por el parásito para propagarse dentro del huéspedxxxviii. Además, la evidencia a la fecha afirma que el tejido adiposo, es el mayor reservorio para T. cruzi, el cual se puede reactivar durante periodos de inmunosupresión y crear un estado de inflamación que afecta a una variedad de vías metabólicasxxxix.
Entre las limitaciones para esta investigación fue desconocer a qué tipo de cepa o unidades taxonómicas discretas (DTU con sus siglas en inglés) pertenecía el parásito, estos son métodos para clasificar genéticamente que se han estado desarrollando con anterioridad para determinar las diferentes formas de interactuar con su hospedero y su distribución geográfica, algunos estudios revelan que en El Salvador prevalece el denominado Trypanosoma cruzi I (TcI) según esta clasificación, pero hay que tener en cuenta que puede variar de TcI a TcVI a nivel de latinoaméricaxl,xli. Otra limitante importante, fue no contar con cortes histológicos de los posibles órganos infectados principalmente del bazo, ya que hubiera permitido observar la ausencia o presencia de nidos de amastigotes en los tejidos y confirmar cuál de las cepas y/o sexos de este estudio era más resistente o vulnerable al parásito según el daño ocasionadoxli.
Algunas de las recomendaciones más sobresalientes es realizar estudios de biología molecular como el análisis de expresión de genes a través de la técnica de reacción en cadena de la polimerasa cuantitativa (qPCR, con sus siglas en inglés) y las técnicas de inmunohistoquímica, la cual permite medir la expresión de proteínas y así obtener una información más detallada para la interpretación de los resultados en base a los genes involucrados para combatir esta enfermedad por parte del hospedadorxxviii,xlii. Hay que tener en cuenta, que existen otras pruebas como las in vitro las cuales pueden permitir obtener resultados más confiables y concluyentes.
Conclusión
El grupo de ratones machos de la cepa BALB/c fue el más susceptible, presentando el mayor incremento de parásitos en la sangre en comparación con los otros grupos infectados. Por otro lado, el grupo de hembras de esta misma cepa fue el que presentó más resistencia en cuanto a la carga parasitaria observada. Sin embargo, en la cepa NIH, se observaron patrones contrarios, por lo que es difícil afirmar que el sexo sea un factor que determine en el comportamiento de esta enfermedad. En cuanto al peso corporal, el tamaño y peso de los órganos, principalmente en el corazón, no presentaron diferencias significativas, esto podría deberse a que algunos probablemente no estarían en ese momento tan infectados, caso contrario lo sucedido con el bazo.
En cuanto al peso corporal, el tamaño y el peso de los órganos (corazón y bazo) muestran resultados difíciles de explicar.
Agradecimiento
A los estudiantes de la Escuela de Biología que participaron en esta investigación para la obtención de los resultados.
Financiamiento
No hubo fuentes de financiamiento externo.
- Duschak V. G. Sulfatación y sulfotopes en Trypanosoma cruzi, agente causal de la Enfermedad de Chagas. Ciencia e investigación. 2022;72(3):59-78. Disponible en: http://hdl.handle.net/11336/230541
- Murillo-Godínez. Enfermedad de Chagas (tripanosomiasis americana). Med. interna Méx. 2018;34(6):959-970. DOI: 10.24245/mim.v34i6.2217
- Álvarez-Hernández DA, Franyuti-Kelly GA, Díaz-López-Silva R, González-Chávez AM, González-Hermosillo-Cornejo D, Vázquez-López R. Chagas disease: Current perspectives on a forgotten disease. Revista Médica del Hospital General de México. 2018;81(3):154-164. DOI: 10.1016/j.hgmx.2016.09.010
- Avalos-Borges EE, Rios LE, Jiménez-Coello M, Ortega-Pacheco A, Garg NJ. Animal Models of Trypanosoma cruzi Congenital Transmission. Pathogens. 2022;11(10):1172. DOI: 10.3390/pathogens11101172
- Peña-Callejas G, González J, Jiménez-Cortés JG, Fuentes-Vicente JA, Salazar-Schettino PM, Bucio-Torres MI. et al. Enfermedad de Chagas: biología y transmisión de Trypanosoma cruzi. TIP Revista Especializada en Ciencias Químico-Biológicas. 2022;25:e449. DOI: 10.22201/fesz.23958723e.2022.449
- Kaufman CD, Farré C, Biscari L, Pérez AR, Alloatti A. Trypanosoma cruzi, Chagas disease and cancer: putting together the pieces of a complex puzzle. Front Cell Dev Biol. 2023;11:1260423. DOI: 10.3389/fcell.2023.1260423
- González FB. Modulación inmuno-endócrina y metabólica en la infección por Trypanosoma cruzi. rephip.unr.edu.ar. 2017. Fecha de consulta: 22 de marzo de 2023. Disponible en: http://hdl.handle.net/2133/7327
- Arias-Del-Angel JA, Santana-Solano J, Santillán M, Manning-Cela RG. Motility patterns of Trypanosoma cruzi trypomastigotes correlate with the efficiency of parasite invasion in vitro. Sci Rep. 2020;10(1):15894. DOI: 10.1038/s41598-020-72604-4
- Macaluso G, Grippi F, Di Bella S, Blanda V, Gucciardi F, Torina A, et al. A Review on the Immunological Response against Trypanosoma cruzi. Pathogens. 2023;12(2):282. DOI: 10.3390/pathogens12020282
- Queiroga TBD, Pereira NS, da Silva DD, Andrade CM, de Araújo Júnior RF, Brito CRDN, et al. Virulence of Trypanosoma cruzi Strains Is Related to the Differential Expression of Innate Immune Receptors in the Heart. Front Cell Infect Microbiol. 2021;11:696719. DOI: 10.3389/fcimb.2021.696719
- The ARRIVE Guidelines: Animal Research: Reporting of In Vivo. Experiments. Originally published in PLOS Biology, 2010. Disponible en: https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.1000412#:~:text=The%20ARRIVE%20guidelines%20consist%20of,)%3B%20details%20of%20housing%20and
- Muradás RMG, Bosque PM, Del Carmen Sansón Ortega M, Pintos RRS. Química.Primera edición. Mexico. Grupo Editorial Patria. 2014. 225 p.
- Figueiredo VP, Silva MC, Souza DMS, Coelho Junior D, Lopes LR, Azevedo MA, et al. Trypanosoma cruzi infection increases atherosclerotic lesion in ApoE-deficient mice. Microb Pathog. 2022;171:105730. DOI: 10.1016/j.micpath.2022.105730
- González Florencia. Modulación inmunoendocrina y metabólica en la infección por Trypanosoma cruzi. Argentina. Instituto de Inmunología Clínica y Experimental de Rosario, Universidad Nacional de Rosario. 2017. Fecha de consulta: 22 de marzo de 2023. Disponible en: http://hdl.handle.net/2133/7327
- Sousa Oliveira CV, Moreno-Loaiza O, Figueiredo-Vanzan D, Peroba Ramos I, Mata-Santos H, Torres Bozza M, et al. IL-1β is not critical to chronic heart dysfunction in mice with Chagas disease. Front Immunol. 2022;13:1010257. DOI: 10.3389/fimmu.2022.1010257
- Flores-Villegas AL, Jiménez-Cortés JG, González J, Moreno-Rodríguez A, Pérez-Cabeza de Vaca R, Segal-Kischinevzky C, et al. Parasitemia and Differential Tissue Tropism in Mice Infected with Trypanosoma cruzi Isolates Obtained from Meccus phyllosoma in the State of Oaxaca, Mexico. Pathogens. 2022;11(10):1141. DOI: 10.3390/pathogens11101141
- do Carmo Neto JR, da Costa AWF, Braga YLL, Lucio FH, Dos Santos Martins ALM, Dos Reis MA, et al. The Colombian Strain of Trypanosoma cruzi Induces a Proinflammatory Profile, Neuronal Death, and Collagen Deposition in the Intestine of C57BL/6 Mice Both during the Acute and Early Chronic Phase. Mediators Inflamm. 2022;1:7641357. DOI: 10.1155/2022/7641357
- Pérez AR, Morrot A, Carvalho VF, de Meis J, Savino W. Role of Hormonal Circuitry Upon T Cell Development in Chagas Disease: Possible Implications on T Cell Dysfunctions. Front Endocrinol. 2018;9:334. DOI: 10.3389/fendo.2018.00334
- Quintanar JL, Salinas E. Papel dual de la leptina en la obesidad. Lux Médica. 2022;17(50). DOI: 10.33064/50lm20223664
- de Oliveira Cardoso F, Salles Domingues C, Zaverucha do Valle T, da Silva Calabrese K. How Do Mouse Strains and Inoculation Routes Influence the Course of Experimental Trypanosoma cruzi Infection? Chagas Disease – From Cellular and Molecular Aspects of Trypanosoma cruzi-Host Interactions to the Clinical Intervention. 2022. DOI: 10.5772/intechopen.104461
- Reboreda-Hernandez Oscar A, Gonzalez-Rodriguez Nayeli, Cruz-Gonzalez Andrea Rebeca, Roman-Cedillo Alan, Ortiz-Butron Roció. Influencia de la inoculación oral en la enfermedad de Chagas en modelo murino. Horiz. sanitario. Fecha de consulta: 3 de enero de 2023. 2021;20(2):198-206. Disponible en: http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2007-74592021000200198
- Jansen AM, Xavier SC, Roque ALR. Trypanosoma cruzi transmission in the wild and its most important reservoir hosts in Brazil. Parasites Vectors. 2018;11(1):502. DOI: 10.1186/s13071-018-3067-2
- Ramírez-Toloza G, Sosoniuk-Roche E, Valck C, Aguilar-Guzmán L, Ferreira VP, Ferreira A. Trypanosoma cruzi Calreticulin: Immune Evasion, Infectivity, and Tumorigenesis. Trends Parasitol. 2020;36(4):368-381. DOI: 10.1016/j.pt.2020.01.007
- León CM, Montilla M, Vanegas R, Castillo M, Parra E, Ramírez JD. Murine models susceptibility to distinct Trypanosoma cruzi I genotypes infection. Parasitology. 2017;144(4):512-519. DOI: 10.1017/S0031182016001980
- De Castro TBR, Canesso MCC, Boroni M, Chame DF, Souza DL, de Toledo NE, et al. Differential Modulation of Mouse Heart Gene Expression by Infection With Two Trypanosoma cruzi Strains: A Transcriptome Analysis. Front Genet. 2020;11:1031. DOI: 10.3389/fgene.2020.01031
- Ramírez-Toloza G, Ferreira A. Trypanosoma cruzi Evades the Complement System as an Efficient Strategy to Survive in the Mammalian Host: The Specific Roles of Host/Parasite Molecules and Trypanosoma cruzi Calreticulin. Front Microbiol. 2017;8:1667. DOI: 10.3389/fmicb.2017.01667
- Mateus J, Guerrero P, Lasso P, Cuervo C, González JM, Puerta CJ, Cuéllar A. An Animal Model of Acute and Chronic Chagas Disease with the Reticulotropic Y Strain of Trypanosoma cruzi That Depicts the Multifunctionality and Dysfunctionality of T Cells. Front Immunol. 2019;10:918. DOI: 10.3389/fimmu.2019.00918
- San Francisco J, Astudillo C, Vega JL, Catalán A, Gutiérrez B, Araya JE, et al. Trypanosoma cruzi pathogenicity involves virulence factor expression and upregulation of bioenergetic and biosynthetic pathways. Virulence. 2022;13(1):1827-1848. DOI: 10.1080/21505594.2022.2132776
- Holguín-Barrera ML, García-Agudelo L, Vargas-Rodríguez LJ, Vacca Bryan F. Chagas agudo por transmisión oral: serie de casosOrally transmitted acute Chagas: a case series. Rev. Colomb. Cardiol. 2023;30(4):203-206. DOI: 10.24875/rccar.22000045
- Moulton VR. Sex Hormones in Acquired Immunity and Autoimmune Disease. Front Immunol. 2018;9:2279. DOI: 10.3389/fimmu.2018.02279
- Lasrado N, Jia T, Massilamany C, et al. Mechanisms of sex hormones in autoimmunity: focus on EAE. Biol Sex Differ 2020;11(1):50. DOI: 10.1186/s13293-020-00325-4
- Lugo-Villarino G, Cougoule C, Meunier E, Rombouts Y, Vérollet C, Balboa L. Editorial: The Mononuclear Phagocyte System in Infectious Disease. Front Immunol. 2019;10:1443. DOI: 10.3389/fimmu.2019.01443
- Reyes AC, Encina JLR. Trypanosoma cruzi Infection: Mechanisms of Evasion of Immune Response. In: De Souza, W., editor. Biology of Trypanosoma cruzi. London: IntechOpen. 2019. DOI: 10.5772/intechopen.84359
- Scott NA, Mann ER. Regulation of mononuclear phagocyte function by the microbiota at mucosal sites. Immunology. 2020;159(1):26-38. DOI: 10.1111/imm.13155
- Hines Chaves KD, Zumbado Vásquez R, Castro Corrales V. Enfermedad de Chagas: afección cardiaca. Rev Medica Sinerg. 2019;4(5):101-10. DOI: 10.31434/rms.v4i5.212
- Lizardo K, Ayyappan JP, Oswal N, Weiss LM, Scherer PE, Nagajyothi JF. Fat tissue regulates the pathogenesis and severity of cardiomyopathy in murine chagas disease. PLoS Negl Trop Dis. 2021;15(4):e0008964. DOI: 10.1371/journal.pntd.0008964
- Gutierrez BC, Lammel E, González-Cappa SM, Poncini CV. Early Immune Response Elicited by Different Trypanosoma cruzi Infective Stages. Front Cell Infect Microbiol. 2021;11:768566. DOI: 10.3389/fcimb.2021.768566
- Soprano LL, Ferrero MR, Landoni M, García GA, Esteva MI, Couto AS, Duschak VG. Cruzipain Sulfotopes-Specific Antibodies Generate Cardiac Tissue Abnormalities and Favor Trypanosoma cruzi Infection in the BALB/c Mice Model of Experimental Chagas Disease. Front Cell Infect Microbiol. 2022;11:814276. DOI: 10.3389/fcimb.2021.814276
- Vega-Robledo Gloria Bertha, Rico-Rosillo María Guadalupe. Tejido adiposo: función inmune y alteraciones inducidas por obesidad. Rev. alerg. Méx. 2019;66(3):340-353. DOI: 10.29262/ram.v66i3.589
- Padilla CP, Alvarado U, Ventura G, Luna Caipo D, Suárez M, Tuñoque JR, et al. Detección de unidades discretas de tipificación de Trypanosoma cruzi en triatominos recolectados en diferentes regiones naturales de Perú. biomedica. 2017; 37(2):167-79. Disponible en: https://revistabiomedica.org/index.php/biomedica/article/view/3559
- Villagran-Herrera ME, Martínez-Ibarra JA, Sánchez-Moreno M, Hernández-Montiel HL, Mercado-Curiel RF, Camacho-Calderón N, et al. The Mouse Model as a Tool for Histological, Immunological and Parasitological Studies of Trypanosoma cruzi Infection. Chagas Disease – Basic Investigations and Challenges. InTech; 2018. DOI: 10.5772/intechopen.77168
- Chatelain E, Scandale I. Animal models of Chagas disease and their translational value to drug development. Expert Opin Drug Discov. 2020;15(12):1381-1402. DOI: 10.1080/17460441.2020.1806233
Citación recomendada: Ramírez Merches CB, Campos Portillo WM, González Pérez AM, Mejía Valencia JG. Efectos de la infección del Trypanosoma cruzi en ratones de las cepas Balb/c y NIH. Alerta. 2024;7(2):152-160. DOI: 10.5377/alerta.v7i2.16425









